
ACTA CIENTÍFICA Y TECNOLÓGICA
REVISTA DE LA ASOCIACIÓN ESPAÑOLA DE CIENTÍFICOS Nº 2 AÑO 2000
Resumen
Las Encefalopatías Espongiformes Transmisibles (EET) son enfermedades raras, con periodos de incubación largos (meses a años), que afectan al sistema nervioso central y progresan lentamente hasta la muerte del enfermo. En los animales, la EET más conocida actualmente es la encefalopatía espongiforme bovina (EEB) o "mal de las vacas locas". En el ser humano de conocen este tipo de enfermedades desde hace más de 80 años y dan lugar a cuadros clínicos conocidos como enfermedad de Creutzfeldt-Jakob, kuru, insomnio fatal, etc. A pesar de su rareza en el ser humano, las enfermedades por priones han adquirido una importancia social elevada debido, por una parte, a la posible conexión entre una nueva variante de enfermedad de Creutzfeldt-Jakob (vECJ) que se describió en 1995 en humanos y la encefalopatía espongiforme bovina. En las EET hay bastantes evidencias a favor de que el agente causal sea una proteína resistente a proteasas (prión) y no un virus, que sorprendentemente existe normalmente en el huésped, con una estructura algo distinta ("prión sano"), aunque hay evidencias que indican que otras proteínas (Dpl o doppel) también podría participar en la patogenia de estas enfermedades.
Hasta el momento, se han declarado 182.507 reses enfermas de EEB en todo el mundo, la mayoría (179.441) en el Reino Unido, y se han confirmado 13 casos en España. Por otra parte, se han observado 91 pacientes afectados de vECJ, principalmente en el Reino Unido. La importancia de la aparición de la vECJ es que el agente causal ha sido capaz de saltar la llamada "barrera de las especies". Aunque experimentalmente se ha transmitido en animales, no hay evidencias directas de transmisión de vECJ a través de transfusión sanguínea o vacunas en humanos. Desconocemos el número de casos de vECJ que aparecerán en los próximo años, pero conviene destacar que la incidencia de nuevos casos en el Reino Unido ha permanecido baja durante estos años
Las Encefalopatías Espongiformes Transmisibles (EET) son enfermedades raras, con periodos de incubación largos (meses a años), que afectan al sistema nervioso central y progresan lentamente hasta la muerte del enfermo. En los animales, la EET más conocida actualmente es la encefalopatía espongiforme bovina (EEB) o "mal de las vacas locas". En el ser humano de conocen este tipo de enfermedades desde hace más de 80 años y dan lugar a cuadros clínicos conocidos como enfermedad de Creutzfeldt-Jakob, kuru, insomnio fatal, etc. A pesar de su rareza en el ser humano, las enfermedades por priones han adquirido una importancia social elevada debido, por una parte, a la posible conexión entre una nueva variante de enfermedad de Creutzfeldt-Jakob (vECJ) que se describió en 1995 en humanos y la encefalopatía espongiforme bovina. En las EET hay bastantes evidencias a favor de que el agente causal sea una proteína resistente a proteasas (prión) y no un virus, que sorprendentemente existe normalmente en el huésped, con una estructura algo distinta ("prión sano"), aunque hay evidencias que indican que otras proteínas (Dpl o doppel) también podría participar en la patogenia de estas enfermedades.
Hasta el momento, se han declarado 182.507 reses enfermas de EEB en todo el mundo, la mayoría (179.441) en el Reino Unido, y se han confirmado 13 casos en España. Por otra parte, se han observado 91 pacientes afectados de vECJ, principalmente en el Reino Unido. La importancia de la aparición de la vECJ es que el agente causal ha sido capaz de saltar la llamada "barrera de las especies". Aunque experimentalmente se ha transmitido en animales, no hay evidencias directas de transmisión de vECJ a través de transfusión sanguínea o vacunas en humanos. Desconocemos el número de casos de vECJ que aparecerán en los próximo años, pero conviene destacar que la incidencia de nuevos casos en el Reino Unido ha permanecido baja durante estos años

Introducción
Las enfermedades por priones, también denominadas Encefalopatías Espongiformes Transmisibles (EET), son una familia de enfermedades neurodegenerativas raras, con periodos de incubación largos, lentamente progresivas, y universalmente fatales, que afectan a personas y animales.
La encefalopatía espongiforme bovina (EEB) o "mal de las vacas locas", de la que se han detectado más de 180.000 reses enfermas desde su detección por primera vez en Reino Unido en 1986, pertenece a este grupo de enfermedades, junto con el "scrapie", conocida desde hace unos 250 años. El scrapie sólo afecta a las ovejas y cabras su nombre se debe a que la enfermedad se caracteriza por un intenso prurito que obliga a rascarse (scraping en inglés) a las ovejas, junto con ataxia.
La "enfermedad de Creutzfeldt-Jakob" (ECJ), conocida desde 1920, que afecta al ser humano, también pertenece a este grupo de enfermedades. En 1957 se describió la afectación de seres humanos por una enfermedad similar, llamada kuru, en caníbales de Papúa (Nueva Guinea).
La gran variabilidad de presentación clínica de estas enfermedades por priones requieren otros criterios más objetivos, como los hallazgos anatomopatológicos, para poder clasificar las diversas enfermedades. De esta forma, además de la ECJ y kuru, otras formas descritas de enfermedades priónicas humanas incluyen la enfermedad de Gerstmann-Straussler-Scheinker (GSS) el Insomnio Fatal (IF). En los últimos años se han descrito una variedad de cuadros clínicos de etiopatogenia priónica que han ampliado el espectro clínico de estas enfermedades en humanos: demencia por prión sin patología característica, demencia con paraparesia espástica, Encefalopatia Espongiforme Familiar asociada a nueva mutación en el gen PrP, Gliosis Subcortical Progresiva, o enfermedad mental sin signos neurológicos. Así mismo, casos descritos como enfermedad de Alzheimer familiares han sido reexplorados y catalogados de origen priónico.
A pesar de su rareza en el ser humano, las enfermedades por priones han adquirido una importancia social elevada debido, por una parte, a la posible conexión entre una nueva variante de enfermedad de Creutzfeldt-Jakob que se describió, en 1995, en humanos (que abreviaremos como vECJ) y la encefalopatía espongiforme bovina, y por otra parte, por la posibilidad de contaminación de la sangre humana y de productos derivados de la sangre (como el plasma) por el agente de la vECJ.
Las enfermedades por priones, también denominadas Encefalopatías Espongiformes Transmisibles (EET), son una familia de enfermedades neurodegenerativas raras, con periodos de incubación largos, lentamente progresivas, y universalmente fatales, que afectan a personas y animales.
La encefalopatía espongiforme bovina (EEB) o "mal de las vacas locas", de la que se han detectado más de 180.000 reses enfermas desde su detección por primera vez en Reino Unido en 1986, pertenece a este grupo de enfermedades, junto con el "scrapie", conocida desde hace unos 250 años. El scrapie sólo afecta a las ovejas y cabras su nombre se debe a que la enfermedad se caracteriza por un intenso prurito que obliga a rascarse (scraping en inglés) a las ovejas, junto con ataxia.
La "enfermedad de Creutzfeldt-Jakob" (ECJ), conocida desde 1920, que afecta al ser humano, también pertenece a este grupo de enfermedades. En 1957 se describió la afectación de seres humanos por una enfermedad similar, llamada kuru, en caníbales de Papúa (Nueva Guinea).
La gran variabilidad de presentación clínica de estas enfermedades por priones requieren otros criterios más objetivos, como los hallazgos anatomopatológicos, para poder clasificar las diversas enfermedades. De esta forma, además de la ECJ y kuru, otras formas descritas de enfermedades priónicas humanas incluyen la enfermedad de Gerstmann-Straussler-Scheinker (GSS) el Insomnio Fatal (IF). En los últimos años se han descrito una variedad de cuadros clínicos de etiopatogenia priónica que han ampliado el espectro clínico de estas enfermedades en humanos: demencia por prión sin patología característica, demencia con paraparesia espástica, Encefalopatia Espongiforme Familiar asociada a nueva mutación en el gen PrP, Gliosis Subcortical Progresiva, o enfermedad mental sin signos neurológicos. Así mismo, casos descritos como enfermedad de Alzheimer familiares han sido reexplorados y catalogados de origen priónico.
A pesar de su rareza en el ser humano, las enfermedades por priones han adquirido una importancia social elevada debido, por una parte, a la posible conexión entre una nueva variante de enfermedad de Creutzfeldt-Jakob que se describió, en 1995, en humanos (que abreviaremos como vECJ) y la encefalopatía espongiforme bovina, y por otra parte, por la posibilidad de contaminación de la sangre humana y de productos derivados de la sangre (como el plasma) por el agente de la vECJ.
Otras enfermedades priónicas descritas en animales incluyen la encefalopatía transmisible del visón, la enfermedad devastadora crónica del ciervo y el alce (chronic wasting disease ó CWD), y la encefalopatía espongiforme felina, entre otras. La mayoría de estas enfermedades, incluyendo la EEB, se cree que son debidas a la ingestión de productos animales contaminados con scrapie de oveja (figura 1), aunque la CWD parece ser una enfermedad de aparición natural en Norteamérica.
Todas estas enfermedades tiene dos características comunes: su naturaleza transmisible y sus características anatomopatológicas, incluyendo la vacuolización marcada de la sustancia gris del cerebro, que origina un aspecto en esponja cuando se observa en el microscopio óptico; por ello, estas enfermedades tiene en nombre común de encefalopatías espongiformes transmisibles (EET).
La EEB se caracteriza en los animales por nerviosismo, alta reactividad a estímulos externos y dificultad de movimientos, sobre todo en las extremidades posteriores. La edad media de presentación de los síntomas es de 4 a 5 años.
Todas estas enfermedades tiene dos características comunes: su naturaleza transmisible y sus características anatomopatológicas, incluyendo la vacuolización marcada de la sustancia gris del cerebro, que origina un aspecto en esponja cuando se observa en el microscopio óptico; por ello, estas enfermedades tiene en nombre común de encefalopatías espongiformes transmisibles (EET).
La EEB se caracteriza en los animales por nerviosismo, alta reactividad a estímulos externos y dificultad de movimientos, sobre todo en las extremidades posteriores. La edad media de presentación de los síntomas es de 4 a 5 años.
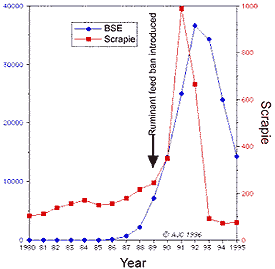
El problema que plateamos en este escrito es si la enfermedad de las "vacas locas" o encefalopatía espongiforme bovina puede ser transmitida al ser humano y qué consecuencias tendría para el ser humano la infección por los priones de la encefalopatía espongiforme bovina.
En octubre de 1995, se produce un hecho crítico, cual es la publicación por Bateman y Britton y cols, como cartas al director de la revista Lancet de los dos primeros casos de lo que se denominará más tarde Enfermedad de Creutzfeldt-Jakob nueva variante (vECJ). Los dos pacientes tenían en común algunas características clínicas que les diferenciaba de la ECJ clásica, sobre todo la edad de presentación, las manifestaciones clínicas (trastorno neuropsiquiátrico progresivo que conduce a ataxia, demencia y mioclonias o corea), la duración y la ausencia del EEG típico. Más tarde, en abril de 1996 Will y cols publican ya una serie de 10 casos de esta vECJ y apuntan a la posibilidad de una relación con la EEB como causa de los mismos.
La variante de la enfermedad de Creutzfeldt-Jakob, descrita casi exclusivamente en el Reino Unido, a diferencia de la descripción original de la enfermedad de Creutzfeldt-Jakob clásica, se ha descrito también en adolescentes y tiene unas características histopatológicas (marcado cambios espongiformes y numerosas placas floridas por todo el cerebro) que la distinguen de la enfermedad de Creutzfeldt-Jakob clásica.
Los estudios de laboratorio, incluyendo los experimentos de transmisión en ratones, proporcionan fuertes evidencias que apoyan la hipótesis que indica que la vECJ está causada por la encefalopatía espongiforme bovina.
En octubre de 1995, se produce un hecho crítico, cual es la publicación por Bateman y Britton y cols, como cartas al director de la revista Lancet de los dos primeros casos de lo que se denominará más tarde Enfermedad de Creutzfeldt-Jakob nueva variante (vECJ). Los dos pacientes tenían en común algunas características clínicas que les diferenciaba de la ECJ clásica, sobre todo la edad de presentación, las manifestaciones clínicas (trastorno neuropsiquiátrico progresivo que conduce a ataxia, demencia y mioclonias o corea), la duración y la ausencia del EEG típico. Más tarde, en abril de 1996 Will y cols publican ya una serie de 10 casos de esta vECJ y apuntan a la posibilidad de una relación con la EEB como causa de los mismos.
La variante de la enfermedad de Creutzfeldt-Jakob, descrita casi exclusivamente en el Reino Unido, a diferencia de la descripción original de la enfermedad de Creutzfeldt-Jakob clásica, se ha descrito también en adolescentes y tiene unas características histopatológicas (marcado cambios espongiformes y numerosas placas floridas por todo el cerebro) que la distinguen de la enfermedad de Creutzfeldt-Jakob clásica.
Los estudios de laboratorio, incluyendo los experimentos de transmisión en ratones, proporcionan fuertes evidencias que apoyan la hipótesis que indica que la vECJ está causada por la encefalopatía espongiforme bovina.
Qué son los priones
Prusiner propuso que una fracción proteica era el origen de estas enfermedades e introdujo el término prión para enfatizar su naturaleza tanto proteica como infecciosa. Aunque ni la teoría viral ni la teoría proteica han sido probadas, hay bastantes evidencias a favor de que se trate sólo de una proteína y no de un virus, por lo que Prusiner obtuvo el premio Nobel de Medicina en 1997.
Se sospechó la naturaleza proteica de este agente infeccioso porque la exposición a radiaciones ionizantes y ultravioleta degradan los ácidos nucleicos pero no reducen la infectividad de las fracciones de scrapie experimentalmente, mientras que los procedimientos que degradan las proteínas, como la exposición prolongada a proteasas, se correlacionan con un menor poder infeccioso. En los cerebros de animales con encefalopatías espongiformes transmisibles se aisló una proteína relativamente resistente a proteasas (figura 2), lo sorprendente fue comprobar que esta proteína se codificaba normalmente por genes de los cromosomas del huésped.
Prusiner propuso que una fracción proteica era el origen de estas enfermedades e introdujo el término prión para enfatizar su naturaleza tanto proteica como infecciosa. Aunque ni la teoría viral ni la teoría proteica han sido probadas, hay bastantes evidencias a favor de que se trate sólo de una proteína y no de un virus, por lo que Prusiner obtuvo el premio Nobel de Medicina en 1997.
Se sospechó la naturaleza proteica de este agente infeccioso porque la exposición a radiaciones ionizantes y ultravioleta degradan los ácidos nucleicos pero no reducen la infectividad de las fracciones de scrapie experimentalmente, mientras que los procedimientos que degradan las proteínas, como la exposición prolongada a proteasas, se correlacionan con un menor poder infeccioso. En los cerebros de animales con encefalopatías espongiformes transmisibles se aisló una proteína relativamente resistente a proteasas (figura 2), lo sorprendente fue comprobar que esta proteína se codificaba normalmente por genes de los cromosomas del huésped.
¿Cómo puede una proteína expresada normalmente ser también un patógeno transmisible?
Los priones son proteínas complejas (cadenas de polipéptidos), cuya estructura se conoce mejor cada día; la proteína del prión se conoce como PrP.
Existen dos isómeros principales de la proteína PrP: la forma celular o no patógena, denominada PrPC, y la forma patógena o forma inductora del scrapie, denominada PrPSc. Tanto PrPC como PrPSc tienen la misma secuencias de aminoácidos, pero difieren en sus propiedades (tabla 1).
Los priones son proteínas complejas (cadenas de polipéptidos), cuya estructura se conoce mejor cada día; la proteína del prión se conoce como PrP.
Existen dos isómeros principales de la proteína PrP: la forma celular o no patógena, denominada PrPC, y la forma patógena o forma inductora del scrapie, denominada PrPSc. Tanto PrPC como PrPSc tienen la misma secuencias de aminoácidos, pero difieren en sus propiedades (tabla 1).
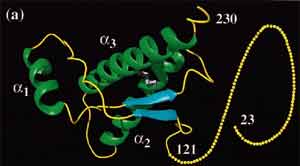
Fig. 2. Estructura tridimensional de la proteína priónica bovina (7).
| Tabla 1. Propiedades de la Proteína de prión sano (PrPC) y patológica (PrPSc) | ||
| Característica | PrPC | PrPSc |
| Bioquímicas | ||
| Solubilidad en detergentes no desnaturalizantes | Soluble | Insoluble |
| Degradación por proteasas | Total | Relativamente resistente |
| Estructurales | ||
| Forma | Predominantemente helicoidal | Al menos un 40% de su estructura es en hoja plegada |
Existen diferencias entre el prión bovino y el prión humano. Los priones "sanos" de cada especie tendrían una distribución de cargas electrostáticas en su superficie que podría ser el origen de la barrera existente entre distintas especies que impiden normalmente la transmisión de enfermedades priónicas entre humanos y bóvidos. De hecho, la conversión hacia una forma en hoja plegada parece ser un hecho fundamental en las enfermedades priónicas.
¿Cómo se convierte PrPC en PrPSc?
Algunos autores denominan prión sólo a la forma alterada de la proteína celular funcional que ha perdido su función normal pero que ha adquirido la capacidad de transformar la forma normal en patológica.
Los priones son infecciosos a pesar de carecer de ácidos nucleicos con información genética. La transmisión se cree que se realiza mediante la conversión de una proteína normal en el huésped en una forma similar patológica.
Los mecanismos que posiblemente inician la conversión de PrPC a PrPSc incluyen a) mutaciones de línea germinal del gen de la proteína priónica humana (PRNP), b) una mutación somática dentro de una neurona determinada, y c) conversión espontánea del PrPC en una conformación aberrante que no se pliega de forma apropiada en su estructura nativa.
Independientemente del mecanismo de inicio, una vez que se ha generado una "unidad infecciosa", PrPSc parece actuar como una plantilla conformacional mediante la cual PrPC se convierte en una nueva molécula de PrPSc mediante interacción entre las proteínas de PrPC y PrPSc . De hecho, se ha observado que los ratones a los que se les ha eliminado el gen normal PrP no desarrollan la enfermedad por priones tras la inoculación con scrapie. Además, los ratones transgénicos (Tg) que expresan un gen quimérico (de dos especies distintas) hecho de segmentos humanos (Hu) y de ratón (M), llamados Tg(MHu2M), desarrollan priones PrPSc quiméricos ratón-humanos proteasa-resistentes en sus cerebros, cuando son inoculados con extractos de cerebro de humanos con enfermedad por priones.
Por lo tanto, los priones no se auto-replican sino que se convierten de PrPC no patógenos a PrPSc patógenos.
Algunos autores denominan prión sólo a la forma alterada de la proteína celular funcional que ha perdido su función normal pero que ha adquirido la capacidad de transformar la forma normal en patológica.
Los priones son infecciosos a pesar de carecer de ácidos nucleicos con información genética. La transmisión se cree que se realiza mediante la conversión de una proteína normal en el huésped en una forma similar patológica.
Los mecanismos que posiblemente inician la conversión de PrPC a PrPSc incluyen a) mutaciones de línea germinal del gen de la proteína priónica humana (PRNP), b) una mutación somática dentro de una neurona determinada, y c) conversión espontánea del PrPC en una conformación aberrante que no se pliega de forma apropiada en su estructura nativa.
Independientemente del mecanismo de inicio, una vez que se ha generado una "unidad infecciosa", PrPSc parece actuar como una plantilla conformacional mediante la cual PrPC se convierte en una nueva molécula de PrPSc mediante interacción entre las proteínas de PrPC y PrPSc . De hecho, se ha observado que los ratones a los que se les ha eliminado el gen normal PrP no desarrollan la enfermedad por priones tras la inoculación con scrapie. Además, los ratones transgénicos (Tg) que expresan un gen quimérico (de dos especies distintas) hecho de segmentos humanos (Hu) y de ratón (M), llamados Tg(MHu2M), desarrollan priones PrPSc quiméricos ratón-humanos proteasa-resistentes en sus cerebros, cuando son inoculados con extractos de cerebro de humanos con enfermedad por priones.
Por lo tanto, los priones no se auto-replican sino que se convierten de PrPC no patógenos a PrPSc patógenos.
La proteína prión en humanos
En los humanos, el gen de la proteína priónica humana, PRNP, se localiza en el cromosoma 20 y codifica una PrP de 253 aminoácidos. Esta PrP es glucosilada en dos lugares unidos a la asparagina y se une a la superficie celular mediante un gancho glucosil-fosfatidil-inositol (GPI).
La PrP es regulada durante el desarrollo y constitucionalmente se expresa normalmente en el adulto. El mayor nivel de expresión de PrP se identifica dentro de las neuronas, pero también se identifican niveles más bajos en otros tejidos periféricos como pulmón, corazón, riñón, páncreas, testículos, leucocitos sanguíneos y plaquetas. Inmunohistoquímicamente se ha detectado PrPC también en la unión neuromuscular. También se ha descrito el transporte neuronal periférico y central anterógrado de PrPC.
La función normal del PrPC no se conoce, pero hay datos que sugieren que participe en la función sináptica y en la unión al cobre. Experimentalmente, cuando en los ratones en los que el gen PrP es deleccionado, en algunos estudios no se observan anomalías de desarrollo o del comportamiento, y otros muestran ligeras alteraciones del ritmo circadiano o ataxia. La causa de esta ataxia podría ser la sobreexpresión de un gen próximo al PRNP, denominado PRND, que produce una proteína llamada Dpl ó doppel ("doble") que es homólogo en un 25% con el extremo carboxilo del PrP de ratón.
Aunque los principales cambios patológicos aparecen en el encéfalo, el agente infeccioso pronto se acumula en el tejido linfoide. La aparición o no de enfermedad clínicamente manifiesta depende de la presencia de un sistema inmune intacto, incluyendo linfocitos B maduros.
Collinge y colaboradores, en octubre de 1996, publicaron los primeros análisis moleculares de la Proteina Priónica (PrP), en concreto los patrones de glucosilación de la misma mediante Western blot. El Western blot de la PrP de extractos de cerebro infectado por priones revela 3 bandas mayores, que se corresponden a PrP que tienen una, dos o ninguna cadena de polisacaridos unidos a la parte amino-terminal. En los cerebros con priones, el tratamiento con esta proteasa, condiciona un incremento de la movilidad de estos 3 tipos de moléculas debido a un aumento en las roturas de las terminales amino. En la ECJ esporádica aparecen dos patrones de movilidad, denominados tipo 1 (corresponde con los homocigotos para Met) y 2 (homocigotos para Val), en la ECJ iatrógena por vía periférica presenta un patrón nuevo tipo 3 y en la vECJ y la EEB presenta un patrón también diferente, tipo 4. En animales infectados con material de EEB se mantenía este patrón de glucosilación (tipo 4), que corresponde a una alta proporción de PrP biglucosilada. La conclusión fue que se trataba posiblemente de la misma cepa de prión.
No se conoce aún el mecanismo por el que las células mueren al generarse los priones. El simple acúmulo de proteína patógena parece no ser suficiente para explicar la enfermedad, aunque debe ser un factor esencial en la disfunción celular.
Algunos estudios indican que el diagnóstico de vECJ podría confirmarse mediante biopsias de amígdala palatina, pues hasta el momento sólo es posible realizarlo en biopsias cerebrales o en el estudio autópsico.
La detección de la PrP de la CJD es hoy el marcador diagnóstico más fiable de las enfermedades por priones. Puede ser detectada mediante técnicas de Western blot, histoblot, microscopía electrónica, pero tienen el inconveniente de que requieren material fresco lo cual disminuye su uso debido a la capacidad infectiva de la proteína priónica.
Otra posibilidad es la detección mediante técnicas de inmunohistoquímica realizadas sobre material fijado en formol e incluído en parafina, al que se ha realizado un paso previo por ácido fórmico para anular la infectividad. PrPC es una proteína frágil que puede ser preservada sólo con procedimientos especiales de inclusión, mientras que la PrP de la CJD parece ser más resistente a la fijación en formol e inclusión en parafina; y aunque los mecanismos moleculares de los sistemas de recuperación antigénica no son bien conocidos, parece ser que éstos pretratamientos, destruyen la PrPC con lo que no interferiría en la detección de la PrP de la CJD. Aunque recientemente se ha desarrollado un anticuerpo que sólo reconoce la isoforma alterada.
El proceso biológico de propagación de un prión se inicia con la interacción de la proteína priónica anómala exógena (PrPSc o PrPCJD) con la proteína priónica "sana" (PrPC) o con una forma parcialmente desnaturalizada de ésta. Por otra parte, mutaciones puntuales y variaciones en la longitud de la cadena polipeptídica de la proteína priónica "sana" así como alteraciones metábolicas pueden desembocar en situaciones patológicas. Las patologías infecciosas serían el resultado de la presencia exógena de PrPSc, es decir del catalizador o efector o del núcleo. Las patologías hereditarias ocurrirían por una desestabilización de la estructura de PrPC o una estabilización de la estructura de PrPSc favoreciendo la población del estado patológico. Por último, las enfermedades esporádicas, aunque de etiología desconocida, podrían surgir por alteraciones metabólicas o bien mutaciones espontáneas que conlleven la formación de PrPSc. Ambos fenómenos aún ocurriendo en una única célula podrían desencadenar la formación de PrPSc y su autopropagación, que se extendería por el sistema nervioso central.
Todos los enfermos de vECJ son homocigotos para metionina en el codon 129 del gen PrP. Si tenemos en cuenta que, aproximadamente, el 40% de la población general tiene ese genotipo, 10% son homocigotos para valina, y 10% heterocigotos, no es sorprendente que los primeros casos de vECJ sean homocigotos para metionina.
La patogenia de las encefalopatías espongiformes transmisibles ha sido mejor estudiada en el scrapie. El tracto gastrointestinal y los ganglios linfáticos abdominales son los primeros órganos infectados, y un año después aparece la infección en el cerebro. La afectación del tracto gastrointestinal implica que, el agente infeccioso probablemente infecta las ovejas a través de la vía oral. En modelos experimentales de scrapie en ratones y cabras, tras la inoculación subcutánea, el agente patógeno también coloniza inicialmente en los tejidos linfáticos y bazo, antes de poder ser detectada en el sistema nervioso central.
En los humanos, el gen de la proteína priónica humana, PRNP, se localiza en el cromosoma 20 y codifica una PrP de 253 aminoácidos. Esta PrP es glucosilada en dos lugares unidos a la asparagina y se une a la superficie celular mediante un gancho glucosil-fosfatidil-inositol (GPI).
La PrP es regulada durante el desarrollo y constitucionalmente se expresa normalmente en el adulto. El mayor nivel de expresión de PrP se identifica dentro de las neuronas, pero también se identifican niveles más bajos en otros tejidos periféricos como pulmón, corazón, riñón, páncreas, testículos, leucocitos sanguíneos y plaquetas. Inmunohistoquímicamente se ha detectado PrPC también en la unión neuromuscular. También se ha descrito el transporte neuronal periférico y central anterógrado de PrPC.
La función normal del PrPC no se conoce, pero hay datos que sugieren que participe en la función sináptica y en la unión al cobre. Experimentalmente, cuando en los ratones en los que el gen PrP es deleccionado, en algunos estudios no se observan anomalías de desarrollo o del comportamiento, y otros muestran ligeras alteraciones del ritmo circadiano o ataxia. La causa de esta ataxia podría ser la sobreexpresión de un gen próximo al PRNP, denominado PRND, que produce una proteína llamada Dpl ó doppel ("doble") que es homólogo en un 25% con el extremo carboxilo del PrP de ratón.
Aunque los principales cambios patológicos aparecen en el encéfalo, el agente infeccioso pronto se acumula en el tejido linfoide. La aparición o no de enfermedad clínicamente manifiesta depende de la presencia de un sistema inmune intacto, incluyendo linfocitos B maduros.
Collinge y colaboradores, en octubre de 1996, publicaron los primeros análisis moleculares de la Proteina Priónica (PrP), en concreto los patrones de glucosilación de la misma mediante Western blot. El Western blot de la PrP de extractos de cerebro infectado por priones revela 3 bandas mayores, que se corresponden a PrP que tienen una, dos o ninguna cadena de polisacaridos unidos a la parte amino-terminal. En los cerebros con priones, el tratamiento con esta proteasa, condiciona un incremento de la movilidad de estos 3 tipos de moléculas debido a un aumento en las roturas de las terminales amino. En la ECJ esporádica aparecen dos patrones de movilidad, denominados tipo 1 (corresponde con los homocigotos para Met) y 2 (homocigotos para Val), en la ECJ iatrógena por vía periférica presenta un patrón nuevo tipo 3 y en la vECJ y la EEB presenta un patrón también diferente, tipo 4. En animales infectados con material de EEB se mantenía este patrón de glucosilación (tipo 4), que corresponde a una alta proporción de PrP biglucosilada. La conclusión fue que se trataba posiblemente de la misma cepa de prión.
No se conoce aún el mecanismo por el que las células mueren al generarse los priones. El simple acúmulo de proteína patógena parece no ser suficiente para explicar la enfermedad, aunque debe ser un factor esencial en la disfunción celular.
Algunos estudios indican que el diagnóstico de vECJ podría confirmarse mediante biopsias de amígdala palatina, pues hasta el momento sólo es posible realizarlo en biopsias cerebrales o en el estudio autópsico.
La detección de la PrP de la CJD es hoy el marcador diagnóstico más fiable de las enfermedades por priones. Puede ser detectada mediante técnicas de Western blot, histoblot, microscopía electrónica, pero tienen el inconveniente de que requieren material fresco lo cual disminuye su uso debido a la capacidad infectiva de la proteína priónica.
Otra posibilidad es la detección mediante técnicas de inmunohistoquímica realizadas sobre material fijado en formol e incluído en parafina, al que se ha realizado un paso previo por ácido fórmico para anular la infectividad. PrPC es una proteína frágil que puede ser preservada sólo con procedimientos especiales de inclusión, mientras que la PrP de la CJD parece ser más resistente a la fijación en formol e inclusión en parafina; y aunque los mecanismos moleculares de los sistemas de recuperación antigénica no son bien conocidos, parece ser que éstos pretratamientos, destruyen la PrPC con lo que no interferiría en la detección de la PrP de la CJD. Aunque recientemente se ha desarrollado un anticuerpo que sólo reconoce la isoforma alterada.
El proceso biológico de propagación de un prión se inicia con la interacción de la proteína priónica anómala exógena (PrPSc o PrPCJD) con la proteína priónica "sana" (PrPC) o con una forma parcialmente desnaturalizada de ésta. Por otra parte, mutaciones puntuales y variaciones en la longitud de la cadena polipeptídica de la proteína priónica "sana" así como alteraciones metábolicas pueden desembocar en situaciones patológicas. Las patologías infecciosas serían el resultado de la presencia exógena de PrPSc, es decir del catalizador o efector o del núcleo. Las patologías hereditarias ocurrirían por una desestabilización de la estructura de PrPC o una estabilización de la estructura de PrPSc favoreciendo la población del estado patológico. Por último, las enfermedades esporádicas, aunque de etiología desconocida, podrían surgir por alteraciones metabólicas o bien mutaciones espontáneas que conlleven la formación de PrPSc. Ambos fenómenos aún ocurriendo en una única célula podrían desencadenar la formación de PrPSc y su autopropagación, que se extendería por el sistema nervioso central.
Todos los enfermos de vECJ son homocigotos para metionina en el codon 129 del gen PrP. Si tenemos en cuenta que, aproximadamente, el 40% de la población general tiene ese genotipo, 10% son homocigotos para valina, y 10% heterocigotos, no es sorprendente que los primeros casos de vECJ sean homocigotos para metionina.
La patogenia de las encefalopatías espongiformes transmisibles ha sido mejor estudiada en el scrapie. El tracto gastrointestinal y los ganglios linfáticos abdominales son los primeros órganos infectados, y un año después aparece la infección en el cerebro. La afectación del tracto gastrointestinal implica que, el agente infeccioso probablemente infecta las ovejas a través de la vía oral. En modelos experimentales de scrapie en ratones y cabras, tras la inoculación subcutánea, el agente patógeno también coloniza inicialmente en los tejidos linfáticos y bazo, antes de poder ser detectada en el sistema nervioso central.
Incidencia
Encefalopatía Espongiforme Bovina
En 1987 Wells y cols describieron cambios espongiformes en el cerebro de una vaca afectada de EEB. El origen de la epidemia de EEB podría estar relacionado con un cambio en el proceso de explotación ganadera en 1981, de forma que los priones de EEB no fueron completamente inactivados antes de alimentar a las vacas con carne y huesos procedentes de otras vacas infectadas.
Hasta el momento, a nivel mundial, se han declarado 182.507 reses enfermas de EEB (179.441 en el Reino Unido). La mayor incidencia tuvo lugar en 1992 (37.316 casos a nivel mundial, de las que 37.056 correspondían al Reino Unido), y desde entonces la frecuencia global ha disminuido hasta 1.830 casos en el año 2000, por el descenso de casos en el Reino Unido (1.312 casos en el año 2000), aunque en el resto de los países europeos la incidencia ha aumentado en estos últimos años. Hasta la fecha, se han confirmado 13 casos en España.
En Gran Bretaña, fueron sacrificadas más de 2 millones de reses. En diciembre de 1999, el Ministerio de Agricultura, Pesa y Alimentación declaró la cabaña británica "segura" y libre de EEB.
La incidencia de encefalopatía espongiforme en gatos en el Reino Unido también ha disminuido significativamente desde 1994.
Enfermedad de Creutzfeldt Jacob clásica
La ECJ en su variante esporádica o no familiar es la enfermedad por priones más frecuente (85%) en humanos. Las enfermedades por priones en humanos ocurren en todo el mundo, con una incidencia global de 1 caso por cada millón de habitantes al año en la enfermedad esporádica y de 1 caso por cada 10 ó 100 millones de habitantes en la enfermedad familiar. No hay predominio de sexos.
En la ECJ clásica no se han descrito factores de riesgo no iatrogénicos. Se han descrito agrupaciones de casos en Israel, Eslovaquia, Chile y Francia, que corresponden a casos de ECJ familiar con mutaciones en el gen PRNP.
En España, la cifra de mortalidad de las enfermedades priónicas es de 0,69 por millón, algo inferior al resto de los países Europeos (desde 0,97 en Reino Unido hasta 1,37 en Francia), observándose un discreto aumento en esta frecuencia entre 1993 y 2000 en todos los países europeos (excepto en Suiza), algo más marcado en el año 1998.
Al incluir los casos "posibles" de ECJ, en España, el Registro Nacional de Encefalopatías Transmisibles Humanas (EETH) ha recogido (hasta el 1 de febrero de 2001) un total de 337 casos, entre los años 1993 y 2000 (tabla 2).
Encefalopatía Espongiforme Bovina
En 1987 Wells y cols describieron cambios espongiformes en el cerebro de una vaca afectada de EEB. El origen de la epidemia de EEB podría estar relacionado con un cambio en el proceso de explotación ganadera en 1981, de forma que los priones de EEB no fueron completamente inactivados antes de alimentar a las vacas con carne y huesos procedentes de otras vacas infectadas.
Hasta el momento, a nivel mundial, se han declarado 182.507 reses enfermas de EEB (179.441 en el Reino Unido). La mayor incidencia tuvo lugar en 1992 (37.316 casos a nivel mundial, de las que 37.056 correspondían al Reino Unido), y desde entonces la frecuencia global ha disminuido hasta 1.830 casos en el año 2000, por el descenso de casos en el Reino Unido (1.312 casos en el año 2000), aunque en el resto de los países europeos la incidencia ha aumentado en estos últimos años. Hasta la fecha, se han confirmado 13 casos en España.
En Gran Bretaña, fueron sacrificadas más de 2 millones de reses. En diciembre de 1999, el Ministerio de Agricultura, Pesa y Alimentación declaró la cabaña británica "segura" y libre de EEB.
La incidencia de encefalopatía espongiforme en gatos en el Reino Unido también ha disminuido significativamente desde 1994.
Enfermedad de Creutzfeldt Jacob clásica
La ECJ en su variante esporádica o no familiar es la enfermedad por priones más frecuente (85%) en humanos. Las enfermedades por priones en humanos ocurren en todo el mundo, con una incidencia global de 1 caso por cada millón de habitantes al año en la enfermedad esporádica y de 1 caso por cada 10 ó 100 millones de habitantes en la enfermedad familiar. No hay predominio de sexos.
En la ECJ clásica no se han descrito factores de riesgo no iatrogénicos. Se han descrito agrupaciones de casos en Israel, Eslovaquia, Chile y Francia, que corresponden a casos de ECJ familiar con mutaciones en el gen PRNP.
En España, la cifra de mortalidad de las enfermedades priónicas es de 0,69 por millón, algo inferior al resto de los países Europeos (desde 0,97 en Reino Unido hasta 1,37 en Francia), observándose un discreto aumento en esta frecuencia entre 1993 y 2000 en todos los países europeos (excepto en Suiza), algo más marcado en el año 1998.
Al incluir los casos "posibles" de ECJ, en España, el Registro Nacional de Encefalopatías Transmisibles Humanas (EETH) ha recogido (hasta el 1 de febrero de 2001) un total de 337 casos, entre los años 1993 y 2000 (tabla 2).
| Tabla 2. Registro Español de EETH (29) | |
|---|---|
| Casos EETH | 1993-2000 |
| ECJ Clásica | 323 |
| Esporádica |
|
|
|
|
|
| Variante ECJ | 0 |
| IFF | 14 |
| Total | 337 |
El kuru ha desaparecido, una vez que la población afectada abandonó los hábitos de canibalismo.
Nueva variante de ECJ
Esta forma de enfermedad por priones se ha descrito, entre 1995 y enero de 2001, en 91 pacientes: 88 pacientes británicos, un caso en Irlanda y 2 casos en Francia .
La tabla 3 muestra el número de muertes de casos probables y definitivos en el Reino Unido, hasta el 28 de Diciembre de 2000.
Esta forma de enfermedad por priones se ha descrito, entre 1995 y enero de 2001, en 91 pacientes: 88 pacientes británicos, un caso en Irlanda y 2 casos en Francia .
La tabla 3 muestra el número de muertes de casos probables y definitivos en el Reino Unido, hasta el 28 de Diciembre de 2000.
Tabla 3. Muertes por casos probables y definitivos en el Reino Unido
| Año | ECJ Esporádico | ECJ Latrogénico | ECJ Familiar | GSS | vECJ probable aún vivo | vECJ muertes esperando resultados autopista | vECJ confirmados* | Total |
| 1990 | 28 | 5 | 0 | 0 | - | - | 33 | |
| 1991 | 32 | 1 | 3 | 0 | - | - | 36 | |
| 1992 | 43 | 2 | 5 | 1 | - | - | 51 | |
| 1993 | 38 | 4 | 2 | 2 | - | - | 46 | |
| 1994 | 51 | 1 | 4 | 3 | - | - | 59 | |
| 1995 | 35 | 4 | 2 | 3 | - | 3 | 47 | |
| 1996 | 40 | 4 | 2 | 4 | - | 10 | 60 | |
| 1997 | 59 | 6 | 4 | 1 | - | 10 | 80 | |
| 1998 | 63 | 3 | 4 | 1 | - | 18 | 89 | |
| 1999 | 61 | 6 | 2 | 0 | - | - | 15 | 84 |
| 2000+ | 38 | 0 | 2 | 0 | 5 | 2 | 25 | 72 |
| Total | 488 | 36 | 30 | 15 | 5 | 2 | 81 | 657 |
+ Hasta el 28 de Diciembre de 2000.
Número total de casos definitivos y probables de vECJ =88
*incluyendo 7 muertes probables de vECJ sin conformación neuropatológica.
(Tabla actualizada el 08/01/01)
Número total de casos definitivos y probables de vECJ =88
*incluyendo 7 muertes probables de vECJ sin conformación neuropatológica.
(Tabla actualizada el 08/01/01)
La cifra de muertes por la vECJ se mantuvo relativamente constante hasta que a finales de 1998 Will y cols. describieron una cifra anormalmente alta de muertes por vECJ. Hasta el 28 de diciembre de 2000, en el Reino Unido, se detectaron 81 muertes por vECJ y otros 7 casos probables.
En 1998, se describió por primera vez en España un caso de vECJ en un paciente de 27 años, inglés, procedente de Souhampton, pero hasta el momento no se ha comunicado ningún caso en residentes españoles.
En el Reino Unido entre 1993 y 2000 (7,5 años de estudio) se ha descrito un total de 501 casos de ECJ, incluyendo la vECJ, 34 casos de ECJ familiar (25 con mutación PRNP probada), y 28 casos iatrogénicos. En ese mismo periodo, en España (donde aún no se ha descrito la vECJ) se observó un total de 203 casos de ECJ, 11 casos de ECJ familiar (10 con mutación PRNP probada) y dos casos iatrogénicos (por implantes de duramadre)(¡Error! Marcador no definido.).
En 1998, se describió por primera vez en España un caso de vECJ en un paciente de 27 años, inglés, procedente de Souhampton, pero hasta el momento no se ha comunicado ningún caso en residentes españoles.
En el Reino Unido entre 1993 y 2000 (7,5 años de estudio) se ha descrito un total de 501 casos de ECJ, incluyendo la vECJ, 34 casos de ECJ familiar (25 con mutación PRNP probada), y 28 casos iatrogénicos. En ese mismo periodo, en España (donde aún no se ha descrito la vECJ) se observó un total de 203 casos de ECJ, 11 casos de ECJ familiar (10 con mutación PRNP probada) y dos casos iatrogénicos (por implantes de duramadre)(¡Error! Marcador no definido.).
Características clínicas de la variante de ECJ
La clínica de la vECJ es notablemente distinta a la ECJ esporádica, pues el comienzo se asocia con síntoma psiquiátricos, aparece sobre todo en gente joven (media: 27 años, rango: 16 a 48 años), con un curso algo prolongado de unos 16 meses (rango: 9 a 38 meses) y no se asocia con complejos periódicos en el EEG.
La RNM muestra aumento de intensidad en putámen en imágenes T2.
El cerebro muestra vacuolización difusa y presencia de placas características de núcleo denso que contienen PrP, rodeadas de un halo de cambio espongiforme, denominadas "placas floridas" (figura 3).
En el LCR de enfermos de vECJ no se detecta proteína 14-3-3.
La clínica de la vECJ es notablemente distinta a la ECJ esporádica, pues el comienzo se asocia con síntoma psiquiátricos, aparece sobre todo en gente joven (media: 27 años, rango: 16 a 48 años), con un curso algo prolongado de unos 16 meses (rango: 9 a 38 meses) y no se asocia con complejos periódicos en el EEG.
La RNM muestra aumento de intensidad en putámen en imágenes T2.
El cerebro muestra vacuolización difusa y presencia de placas características de núcleo denso que contienen PrP, rodeadas de un halo de cambio espongiforme, denominadas "placas floridas" (figura 3).
En el LCR de enfermos de vECJ no se detecta proteína 14-3-3.
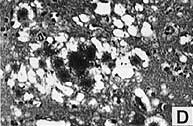
La separación de este cuadro como una entidad clínica separada de la ECJ clásica (tabla 4) viene apoyada por el hallazgo de un PrPSc en el cerebro de los pacientes de vECJ predominantemente bi-glucosilada, con distinta movilidad electroforética a la de la ECJ esporádica, la cual es predominantemente monoglucosilada. El mismo tipo de proteína se observa tras la transmisión experimental de EEB a varios animales, lo que apoya la idea de que la vECJ es consecuencia de una infección de humanos por EEB.
Figura 3. Placas floridas en vECJ
Tabla 4. Diferencias entre la ECJ clásica y la vECJ
| ECJ clásica esporádica | ECJ clásica familiar | vECJ | |
| Frecuencia | 75-85% de casos | 5-10% de casos | 13,3% de casos |
| Edad de inicio | Mayor de 60 años (17-83), rara < 40 años | Variable. Menor de 60 años (20 - 80) | 16 a 52 años (Adolescentes y adultos jóvenes) |
| Duración de la enfermedad | Corta: 4 a 6 meses | Larga: 1a 5 años | Larga: 14 meses |
| Primeros síntomas | Neurológicos: Demencia, ataxia, mioclonias | Neurológicos: Demencia, ataxia, mioclonias | Psiquiátricos, demencia tardía |
| EEG | Carasterístico | Carasterístico | No característico |
| Anatomía Patológica | Espongiosis difusa y gliosis de la sustancia gris. Pocas o ninguna placa amiloide PrP | Espongiosis difusa y gliosis de la sustancia gris. | Placas "floridas" (placas PrP con dentro denso rodeadas de un halo de cambio vacuolar), con extensa afectación cerebelosa, y espongiosis difusa |
| Proteína del prión | Monoglucosilada | Migra a 21 kDa | Altas concentración de forma bi-glucosilada |
| Relación con otras especies | El agente casual es idéntico a la EEB y EEF (felinos) | ||
| Gen PrP | Factores de riesgo: Polimorfismo u homocigosidad en el codon 129 | Mutaciones puntuales, inserciones / delecciones | Homozigotos para metionina en codon 129 |
Tratamiento de las enfermedades por priones
Actualmente, no hay ningún tratamiento farmacológico disponible para las enfermedades por priones, por lo que sólo pueden tomarse medidas sintomáticas. Experimentalmente, los compuestos polisulfatados, como el pentosán polisulfato, suramina, y el heparán sulfato, parecen retrasar la aparición de scrapie en animales, y afecta a la generación de PrPSc en cultivos celulares. Sin embargo, los efectos son mínimos y los compuestos deben ser administrados antes de la inoculación del animal para tener efecto.
El consejo genético es un aspecto fundamental en el manejo de la enfermedad por prión familiar. Aunque es discutible si las pruebas genéticas deben realizarse en los miembros asintomáticos de la familia, la administración Norteamericana ha prohibido la donación de sangre a los familiares de pacientes con enfermedades por priones, a menos que el análisis genético del donante potencial demuestre una secuencia normal del gen PRNP.
Transmisión de EET en humanos.
La naturaleza transmisible de las enfermedades por priones fue demostrada por primera vez experimentalmente en 1936, cuando Cuillé y Chelle transmitieron scrapie a una cabra sana mediante la administración intraocular de médula espinal infectada de scrapie(). Treinta años más tarde, Gajdusek y cols(1966)consiguieron transmitir kuru a chimpancés.
En 1968 Gibbs y cols. transmitieron la ECJ esporádica a chimpancés. En la década de 1960, Carleton Gajdusek confirmó que la enfermedad de Creutzfeldt-Jakob era transmisible. A pesar de haber transcurrido más de tres décadas desde que se comenzó la investigación de la transmisión de enfermedades por priones, la información hoy día disponible se puede definir como fragmentada y e incoherente.
Incluso antes de conocerse la relación entre la vECJ y el "mal de las vacas locas", se sabía que existía una enfermedad de Creutzfeldt-Jakob (llamada iatrogénica) que podía ser transmitida por la administración de la hormona de crecimiento humana y la hormona gonadotropina procedentes de cadáveres, o mediante trasplantes de córnea o de duramadre.
En las enfermedades priónicas en humanos, la mayoría de los casos son esporádicos (son casos generalmente de Enfermedad de Creutzfeld-Jakob), pero también es importante la transmisión familiar o genética (en la Enfermedad de Creutzfeld-Jakob, la enfermedad de Gerstmann-Straussler-Scheinker, el Insomnio Familiar Fatal y la Demencia Talámica). Otras vías de transmisión son la iatrogénica (descrita anteriormente) y, en la enfermedad del kuru por ingesta, en relación con rituales de canibalismo en tribus Fore en Papua, Nueva Guinea.
Ciertas circunstancias en el Reino Unido causaron la aparición y propagación de la EEB en el ganado, entre estas circunstancias se encuentran, por una parte, el empleo frecuente de carne y huesos en piensos que procedían de ovejas infectadas de scrapie y por otra, la adopción de un nuevo tipo de procesamiento que no reducía la cantidad de priones infecciosos tras la elaboración del pienso.
La EEB también ha sido transmitida a rumiantes salvajes en zoológicos del Reino Unido, que fueron infectados al comer los mismos piensos concentrados de carne y huesos contaminados, responsables de la enfermedad en el ganado bovino. También se ha descrito la encefalopatía espongiforme en más de 80 gatos y en algunos felinos de zoológicos británicos.
Hoy en día los estudios se están centrando en probar la ingesta como un factor de riesgo real.
Experimentalmente, se ha confirmado que la encefalopatía espongiforme bovina puede ser transmitida por vía oral e intracerebral a diferentes especies animales (incluyendo primates) con mayor o menor facilidad, aunque, sobre todo, es posible pasarla por vía oral de una vaca a otra con apenas la ingestión de pequeñas cantidades de cerebro. El patrón de la EEB se mantiene a pesar de su paso a un número variable de animales intermedios. Esta firma del prión de la EEB también había sido identificada en animales exóticos y gatos domésticos infectados con la EEB. La firma de la EEB presentaba una gran homogeneidad en su comportamiento y una gran ubicuidad para infectar diversas especies de animales, este hecho no se había visto antes con otros agentes priónicos desde 1963.
La transmisión de ECJ esporádica a primates humanos se consigue en un 85% de los casos. La inoculación a ratones transgénicos que expresan la PrP humana es aún más eficaz, consiguiéndose en casi un 100% de los casos. Esta mejor transmisión en ratones transgénicos que expresan la PrPC humana demuestra la importancia de la homología de secuencia entre PrPSc y PrPC y ayuda a explicar la dificultad en la transmisión entre especies con secuencia PrP distintas, un hecho conocido como "barrera de las especies". Sin embargo, la aparición de la vECJ y la transmisión de priones humanos a ratones transgénicos que expresan PrPC bovino hacen pensar que la secuencia de PrP no es el único factor importante para la transmisión de la enfermedad. El factor determinante puede ser la capacidad de PrPC para adoptar la conformación de PrPSc, la cual debe estar influida tanto por la secuencia de la proteína como por otros factores (ej. proteínas carabina).
El grado de transmisión de GSS a primates no humanos es bajo (40%), comparado con la ECJ. Además, los intentos de transmitir GSS a roedores no han tenido éxito. La escasa capacidad de transmisión de esta enfermedad podría estar relacionada con la escasez relativa de PrP proteasa resistente en el cerebro de los pacientes.
Hasta la fecha, la Unidad de Vigilancia de la ECJ del Reino Unido no ha detectado ningún caso de vECJ consecuencia de procedimientos quirúrgicos o médicos.
Trasmisión por derivados de la sangre
La preocupación actual entre los científicos se centra en la posible transmisión de la enfermedad de Creutzfeldt-Jakob a través de sangre o derivados de la sangre, aunque aún no hay datos firmes epidemiológicos que apoyen este modo de transmisión, sí hay datos de estudios experimentales en laboratorios que conforman que la enfermedad Creutzfeldt-Jakob clásica (no la variante) puede ser transmitida a través de componentes del plasma sanguíneo, aunque su grado de infectividad es mucho menor que en los tejidos cerebrales.
Algunas directivas de la Comunidad Europea (como las del Grupo de Biotecnología del Comité de Productos Médicos Patentados) regulan la comercialización de productos derivados de la sangre (incluyendo por ejemplo plasma, o excipientes de medicamentos). De momento sólo incluyen directamente la exclusión de material procedente de pacientes con enfermedad de Creutzfeldt-Jakob clásica (ya sea esporádica, familiar o iatrogénica), mientras que en el caso de donantes que sufren de la vECJ, desde febrero de 1998, se aconseja descartar este material por precaución, y desde enero de 1999 se recomienda la realización de exámenes de detección de encefalopatías espongiformes transmisibles, en los derivados de la sangre, a pesar que estudios experimentales recientes indican que los procesos realizados durante la producción de productos derivados del plasma parecen eliminar agentes priónicos de forma significativa.
Es posible transmitir la EEB a ovejas mediante la transfusión de sangre entera procedente de otras ovejas asintomáticas alimentadas con reses infectadas de EEB, lo que demuestra que la EEB puede ser transmitida entre individuos de la misma especie a través de transfusión de sangre completa. Sin embargo, aún no hay evidencias directas de transmisión de vECJ a través de transfusión sanguínea en humanos.
La detección de proteína priónica anormal en las amígdalas de individuos infectados por el vECJ ha levantado las sospechas de que la sangre también puede ser una vía de transmisión en la vECJ, incluso más importante en la enfermedad de Creutzfeldt-Jakob clásica, pero este riego aún está por definir.
El Departamento de Salud del Reino Unido ha anunciado que no hay evidencia de transmisión de la vECJ a humanos a través de transfusiones sanguíneas. El riesgo es sólo teórico, pues la sangre completa ya no es utilizada para transfusiones en ese país, puesto que los leucocitos son previamente extraídos mediante leucodeplección. Además, en ese país, el plasma para la elaboración de productos sanguíneos es importado de países con baja incidencia de EEB y sin vECJ.
Para evitar la transmisión de este tipo de enfermedades a través de instrumental médico, dada la alta resistencia de este agente infeccioso a muchos métodos de descontaminación y esterilización, se aconseja la utilización de soluciones esterilizantes, como las basadas en ácido peracético para inactivar los priones.
Aunque en Estados Unidos no se han descrito casos de EEB en animales ni vECJ en humanos, desde Agosto de 1999, el Departamento de Salud de este país prohibieron la donación de sangre de personas que hubiesen residido en Gran Bretaña 6 meses o más entre 1980 y 1996. Estas prohibición podría extenderse a todos los países de Europa Occidental. Se estima que esta medida reduciría el número de donantes de sangre un 5 %.
Medidas a tomar
En Julio de 1988, en el Reino Unido se prohibieron los piensos con proteínas de rumiantes destinados a rumiantes. Esta prohibición logró una disminución de nuevas infecciones. En 1989, la Unión Europea dispuso algunas limitaciones para la venta de ganado vacuno vivo procedente del Reino Unido, y en 1990 se consideró la EEB de declaración obligatoria.
Tras la detección de encefalopatía espongiforme en gatos, en 1990 se prohibió la utilización productos bovinos peligrosos en la industria de comidas para animales domésticos. En 1996, se amplió la prohibición a las proteínas de mamíferos en la alimentación de todas las especies animales en las granjas.
Las medidas adoptadas por la Unión Europea están resumidas en un reciente documento disponible en Internet).
Una vez reconocido el riesgo de transmisión de EEB al ser humano, la principal medida adoptada se adoptó en Noviembre de 1989 al prohibir el uso de ciertos tejidos de bovinos en la comida para humanos, sobre todo aquellos en los que se detectó una mayor concentración del agente infeccioso, como el cerebro, la médula espinal, las amígdalas, bazo, timo, e intestinos de reses mayores de 6 meses de edad. Esta prohibición se ha extendido, desde 1996 a toda la cabeza, excluyendo la lengua. Por otra parte, puesto que la médula espinal puede no ser totalmente extirpada en algunos animales, el gobierno británico prohibió también la columna vertebral en diciembre de 1995 en carne procesada mecánicamente. En marzo de 1996, este gobierno decide que sólo las reses menores de 30 meses son aptas para el consumo humano. De hecho, sólo se han descrito 265 casos en reses menores de 30 meses. Al identificarse el agente infeccioso en los ganglios de las raíces dorsales durante el periodo de incubación, en diciembre de 1997 el gobierno británico decide prohibir la carne con hueso, incluso en animales menores de 30 meses. En marzo de 1996, la Unión Europea prohibió la venta de carne de vaca y productos bovinos procedentes del Reino Unido.
En el momento actual, se han tomado diversas medidas por el Gobierno Británico acerca de la depleción de leucocitos de la sangre, así como de la fabricación de derivados plasmáticos con plasma de fuera del Reino Unido, ante la simple posibilidad hipotética de transmisión de ECJ por derivados hemáticos. Recientemente, también se han publicado datos sobre la posible persistencia de los priones en animales aparentemente sanos, que podrían actuar como reservorios y perpetuar la cadena infectiva.
Además de las cuestiones meramente científicas, otra consecuencias de esta crisis ha sido la revisión de los patrones de conducta más adecuados en el uso y tratamiento de la información científica para su difusión pública a la población, tanto por los medios de comunicación como por los estamentos públicos responsables de la misma. La necesidad de objetividad y claridad absoluta en la información facilitada por los responsables oficiales, así como en la necesidad de disponer de comités de evaluación integrados por personal experto externo y objetivo, que no pueda presentar conflictos de intereses, parece una necesidad cada vez más clara.
La aparición de los nuevos métodos diagnósticos y el incremento de la atención de los clínicos ha modificado las condiciones para el diagnóstico de la ECJ clásica. Los criterios diagnósticos clásicos fueron diseñados para clasificar casos fallecidos. El desarrollo de la genética ha permitido ampliar el diagnóstico en casos portadores de mutaciones con síntomas poco específicos y caracterizar (polimorfismos del codon 129) grupos de susceptibilidad demostrada para los agentes transmitidos por iatrogenia y de posible especial susceptibilidad ante la exposición al agente de la EEB. Las recientes adopciones de nuevos criterios para clasificación en categorías diagnósticas por la OMS y el grupo europeo de vigilancia y estudio de la ECJ suponen la inclusión en los contajes de incidencia a partir del 1998 de los casos "definitivos o ciertos" y los "probables," considerando como casos "probables" los casos "posibles" según Collins y Masters con positividad al test de la 14-3-3. La introducción del test en la practica clínica española en el 1997 supondrá un impacto considerable en las incidencias observadas. La posibilidad de inclusión por este mecanismo de falsos ECJ 14-3-3 positivos sin comprobación post-mortem, por la caída de la proporción de sospechosos con necropsia deberá ser considerada.
La inoculación de extractos de cerebro, médula espinal, ojo, pulmón, hígado, riñón, bazo, ganglio linfático y LCR de pacientes con ECJ puede infectar a primates. Sin embargo, las secreciones, heces y orina no se ha demostrado que transmitan la infección. Por ello, ante un enfermo de ECJ sólo son necesarias medidas preventivas habituales, dado que el riesgo de transmisión a otros miembros de la familia o cuidadores es bajo. No es necesario el aislamiento completo. Sin embargo, deben tomarse precauciones especiales al extraer LCR o al manipular tejidos obtenidos en la autopsia.
Es esencial adoptar medidas de protección para el personal que manipula muestras de tejidos infectados por priones para poder realizar de forma segura los estudios neuropatológicos necesarios. En los laboratorios de anatomía patológica, conviene recordar que al realizar la autopsia de un caso probable de ECJ, deben congelarse muestras del cerebro, generalmente del lóbulo frontal y cerebelo, para poder efectuar un tipaje de proteína de prión y secuenciación del gen de la proteína del prión. Las muestras de los casos de ECJ deben ser manipuladas en campanas de aislamiento (clase 1). Los bloques de tejido que vayan a ser procesados deben ser tratados utilizando agente que inactive el prión, como la inmersión en ácido fórmico puro durante al menos una hora(). Los instrumentos deben ser descontaminados sumergiéndolos en una solución >1N de hidróxido sódico durante al menos 1 hora y luego sometiéndolos a autoclave a 134º C durante al menos 1 hora. Deberán utilizarse instrumentos desechables e incinerar los materiales contaminados siempre que sea posible.
Algunas vacunas están fabricadas con sustancias procedentes de bovinos de países en los que existe la EEB. Sin embargo, el riesgo de transmisión de la vECJ por esta vía se considera remoto y los beneficios de la vacunación sobrepasan a los remotos riesgos de vECJ. Hasta la fecha no existen evidencias de casos de vECJ relacionados con el uso de vacunas. Sin embargo, se recomienda la sustitución paulatina de esas vacunas por otras donde los productos bovinos procedan de países sin riesgo de EEB.
En EE.UU., se estima que un cuarto de las fábricas de piensos no cumplen las regulaciones dispuestas para prevenir la introducción y diseminación de la EEB en ese país, al incluir en esos piensos cerebro y médula espinal.
Se debe pensar en la nueva variante de ECJ ante un paciente joven que desarrolle un cuadro de depresión, al que se asocien alteraciones de la marcha, signos piramidales, extrapiramidales, mutismo acinético o mioclonias, aunque ocurra en un país donde no se haya descrito aún la enfermedad.
Actualmente, no hay ningún tratamiento farmacológico disponible para las enfermedades por priones, por lo que sólo pueden tomarse medidas sintomáticas. Experimentalmente, los compuestos polisulfatados, como el pentosán polisulfato, suramina, y el heparán sulfato, parecen retrasar la aparición de scrapie en animales, y afecta a la generación de PrPSc en cultivos celulares. Sin embargo, los efectos son mínimos y los compuestos deben ser administrados antes de la inoculación del animal para tener efecto.
El consejo genético es un aspecto fundamental en el manejo de la enfermedad por prión familiar. Aunque es discutible si las pruebas genéticas deben realizarse en los miembros asintomáticos de la familia, la administración Norteamericana ha prohibido la donación de sangre a los familiares de pacientes con enfermedades por priones, a menos que el análisis genético del donante potencial demuestre una secuencia normal del gen PRNP.
Transmisión de EET en humanos.
La naturaleza transmisible de las enfermedades por priones fue demostrada por primera vez experimentalmente en 1936, cuando Cuillé y Chelle transmitieron scrapie a una cabra sana mediante la administración intraocular de médula espinal infectada de scrapie(). Treinta años más tarde, Gajdusek y cols(1966)consiguieron transmitir kuru a chimpancés.
En 1968 Gibbs y cols. transmitieron la ECJ esporádica a chimpancés. En la década de 1960, Carleton Gajdusek confirmó que la enfermedad de Creutzfeldt-Jakob era transmisible. A pesar de haber transcurrido más de tres décadas desde que se comenzó la investigación de la transmisión de enfermedades por priones, la información hoy día disponible se puede definir como fragmentada y e incoherente.
Incluso antes de conocerse la relación entre la vECJ y el "mal de las vacas locas", se sabía que existía una enfermedad de Creutzfeldt-Jakob (llamada iatrogénica) que podía ser transmitida por la administración de la hormona de crecimiento humana y la hormona gonadotropina procedentes de cadáveres, o mediante trasplantes de córnea o de duramadre.
En las enfermedades priónicas en humanos, la mayoría de los casos son esporádicos (son casos generalmente de Enfermedad de Creutzfeld-Jakob), pero también es importante la transmisión familiar o genética (en la Enfermedad de Creutzfeld-Jakob, la enfermedad de Gerstmann-Straussler-Scheinker, el Insomnio Familiar Fatal y la Demencia Talámica). Otras vías de transmisión son la iatrogénica (descrita anteriormente) y, en la enfermedad del kuru por ingesta, en relación con rituales de canibalismo en tribus Fore en Papua, Nueva Guinea.
Ciertas circunstancias en el Reino Unido causaron la aparición y propagación de la EEB en el ganado, entre estas circunstancias se encuentran, por una parte, el empleo frecuente de carne y huesos en piensos que procedían de ovejas infectadas de scrapie y por otra, la adopción de un nuevo tipo de procesamiento que no reducía la cantidad de priones infecciosos tras la elaboración del pienso.
La EEB también ha sido transmitida a rumiantes salvajes en zoológicos del Reino Unido, que fueron infectados al comer los mismos piensos concentrados de carne y huesos contaminados, responsables de la enfermedad en el ganado bovino. También se ha descrito la encefalopatía espongiforme en más de 80 gatos y en algunos felinos de zoológicos británicos.
Hoy en día los estudios se están centrando en probar la ingesta como un factor de riesgo real.
Experimentalmente, se ha confirmado que la encefalopatía espongiforme bovina puede ser transmitida por vía oral e intracerebral a diferentes especies animales (incluyendo primates) con mayor o menor facilidad, aunque, sobre todo, es posible pasarla por vía oral de una vaca a otra con apenas la ingestión de pequeñas cantidades de cerebro. El patrón de la EEB se mantiene a pesar de su paso a un número variable de animales intermedios. Esta firma del prión de la EEB también había sido identificada en animales exóticos y gatos domésticos infectados con la EEB. La firma de la EEB presentaba una gran homogeneidad en su comportamiento y una gran ubicuidad para infectar diversas especies de animales, este hecho no se había visto antes con otros agentes priónicos desde 1963.
La transmisión de ECJ esporádica a primates humanos se consigue en un 85% de los casos. La inoculación a ratones transgénicos que expresan la PrP humana es aún más eficaz, consiguiéndose en casi un 100% de los casos. Esta mejor transmisión en ratones transgénicos que expresan la PrPC humana demuestra la importancia de la homología de secuencia entre PrPSc y PrPC y ayuda a explicar la dificultad en la transmisión entre especies con secuencia PrP distintas, un hecho conocido como "barrera de las especies". Sin embargo, la aparición de la vECJ y la transmisión de priones humanos a ratones transgénicos que expresan PrPC bovino hacen pensar que la secuencia de PrP no es el único factor importante para la transmisión de la enfermedad. El factor determinante puede ser la capacidad de PrPC para adoptar la conformación de PrPSc, la cual debe estar influida tanto por la secuencia de la proteína como por otros factores (ej. proteínas carabina).
El grado de transmisión de GSS a primates no humanos es bajo (40%), comparado con la ECJ. Además, los intentos de transmitir GSS a roedores no han tenido éxito. La escasa capacidad de transmisión de esta enfermedad podría estar relacionada con la escasez relativa de PrP proteasa resistente en el cerebro de los pacientes.
Hasta la fecha, la Unidad de Vigilancia de la ECJ del Reino Unido no ha detectado ningún caso de vECJ consecuencia de procedimientos quirúrgicos o médicos.
Trasmisión por derivados de la sangre
La preocupación actual entre los científicos se centra en la posible transmisión de la enfermedad de Creutzfeldt-Jakob a través de sangre o derivados de la sangre, aunque aún no hay datos firmes epidemiológicos que apoyen este modo de transmisión, sí hay datos de estudios experimentales en laboratorios que conforman que la enfermedad Creutzfeldt-Jakob clásica (no la variante) puede ser transmitida a través de componentes del plasma sanguíneo, aunque su grado de infectividad es mucho menor que en los tejidos cerebrales.
Algunas directivas de la Comunidad Europea (como las del Grupo de Biotecnología del Comité de Productos Médicos Patentados) regulan la comercialización de productos derivados de la sangre (incluyendo por ejemplo plasma, o excipientes de medicamentos). De momento sólo incluyen directamente la exclusión de material procedente de pacientes con enfermedad de Creutzfeldt-Jakob clásica (ya sea esporádica, familiar o iatrogénica), mientras que en el caso de donantes que sufren de la vECJ, desde febrero de 1998, se aconseja descartar este material por precaución, y desde enero de 1999 se recomienda la realización de exámenes de detección de encefalopatías espongiformes transmisibles, en los derivados de la sangre, a pesar que estudios experimentales recientes indican que los procesos realizados durante la producción de productos derivados del plasma parecen eliminar agentes priónicos de forma significativa.
Es posible transmitir la EEB a ovejas mediante la transfusión de sangre entera procedente de otras ovejas asintomáticas alimentadas con reses infectadas de EEB, lo que demuestra que la EEB puede ser transmitida entre individuos de la misma especie a través de transfusión de sangre completa. Sin embargo, aún no hay evidencias directas de transmisión de vECJ a través de transfusión sanguínea en humanos.
La detección de proteína priónica anormal en las amígdalas de individuos infectados por el vECJ ha levantado las sospechas de que la sangre también puede ser una vía de transmisión en la vECJ, incluso más importante en la enfermedad de Creutzfeldt-Jakob clásica, pero este riego aún está por definir.
El Departamento de Salud del Reino Unido ha anunciado que no hay evidencia de transmisión de la vECJ a humanos a través de transfusiones sanguíneas. El riesgo es sólo teórico, pues la sangre completa ya no es utilizada para transfusiones en ese país, puesto que los leucocitos son previamente extraídos mediante leucodeplección. Además, en ese país, el plasma para la elaboración de productos sanguíneos es importado de países con baja incidencia de EEB y sin vECJ.
Para evitar la transmisión de este tipo de enfermedades a través de instrumental médico, dada la alta resistencia de este agente infeccioso a muchos métodos de descontaminación y esterilización, se aconseja la utilización de soluciones esterilizantes, como las basadas en ácido peracético para inactivar los priones.
Aunque en Estados Unidos no se han descrito casos de EEB en animales ni vECJ en humanos, desde Agosto de 1999, el Departamento de Salud de este país prohibieron la donación de sangre de personas que hubiesen residido en Gran Bretaña 6 meses o más entre 1980 y 1996. Estas prohibición podría extenderse a todos los países de Europa Occidental. Se estima que esta medida reduciría el número de donantes de sangre un 5 %.
Medidas a tomar
En Julio de 1988, en el Reino Unido se prohibieron los piensos con proteínas de rumiantes destinados a rumiantes. Esta prohibición logró una disminución de nuevas infecciones. En 1989, la Unión Europea dispuso algunas limitaciones para la venta de ganado vacuno vivo procedente del Reino Unido, y en 1990 se consideró la EEB de declaración obligatoria.
Tras la detección de encefalopatía espongiforme en gatos, en 1990 se prohibió la utilización productos bovinos peligrosos en la industria de comidas para animales domésticos. En 1996, se amplió la prohibición a las proteínas de mamíferos en la alimentación de todas las especies animales en las granjas.
Las medidas adoptadas por la Unión Europea están resumidas en un reciente documento disponible en Internet).
Una vez reconocido el riesgo de transmisión de EEB al ser humano, la principal medida adoptada se adoptó en Noviembre de 1989 al prohibir el uso de ciertos tejidos de bovinos en la comida para humanos, sobre todo aquellos en los que se detectó una mayor concentración del agente infeccioso, como el cerebro, la médula espinal, las amígdalas, bazo, timo, e intestinos de reses mayores de 6 meses de edad. Esta prohibición se ha extendido, desde 1996 a toda la cabeza, excluyendo la lengua. Por otra parte, puesto que la médula espinal puede no ser totalmente extirpada en algunos animales, el gobierno británico prohibió también la columna vertebral en diciembre de 1995 en carne procesada mecánicamente. En marzo de 1996, este gobierno decide que sólo las reses menores de 30 meses son aptas para el consumo humano. De hecho, sólo se han descrito 265 casos en reses menores de 30 meses. Al identificarse el agente infeccioso en los ganglios de las raíces dorsales durante el periodo de incubación, en diciembre de 1997 el gobierno británico decide prohibir la carne con hueso, incluso en animales menores de 30 meses. En marzo de 1996, la Unión Europea prohibió la venta de carne de vaca y productos bovinos procedentes del Reino Unido.
En el momento actual, se han tomado diversas medidas por el Gobierno Británico acerca de la depleción de leucocitos de la sangre, así como de la fabricación de derivados plasmáticos con plasma de fuera del Reino Unido, ante la simple posibilidad hipotética de transmisión de ECJ por derivados hemáticos. Recientemente, también se han publicado datos sobre la posible persistencia de los priones en animales aparentemente sanos, que podrían actuar como reservorios y perpetuar la cadena infectiva.
Además de las cuestiones meramente científicas, otra consecuencias de esta crisis ha sido la revisión de los patrones de conducta más adecuados en el uso y tratamiento de la información científica para su difusión pública a la población, tanto por los medios de comunicación como por los estamentos públicos responsables de la misma. La necesidad de objetividad y claridad absoluta en la información facilitada por los responsables oficiales, así como en la necesidad de disponer de comités de evaluación integrados por personal experto externo y objetivo, que no pueda presentar conflictos de intereses, parece una necesidad cada vez más clara.
La aparición de los nuevos métodos diagnósticos y el incremento de la atención de los clínicos ha modificado las condiciones para el diagnóstico de la ECJ clásica. Los criterios diagnósticos clásicos fueron diseñados para clasificar casos fallecidos. El desarrollo de la genética ha permitido ampliar el diagnóstico en casos portadores de mutaciones con síntomas poco específicos y caracterizar (polimorfismos del codon 129) grupos de susceptibilidad demostrada para los agentes transmitidos por iatrogenia y de posible especial susceptibilidad ante la exposición al agente de la EEB. Las recientes adopciones de nuevos criterios para clasificación en categorías diagnósticas por la OMS y el grupo europeo de vigilancia y estudio de la ECJ suponen la inclusión en los contajes de incidencia a partir del 1998 de los casos "definitivos o ciertos" y los "probables," considerando como casos "probables" los casos "posibles" según Collins y Masters con positividad al test de la 14-3-3. La introducción del test en la practica clínica española en el 1997 supondrá un impacto considerable en las incidencias observadas. La posibilidad de inclusión por este mecanismo de falsos ECJ 14-3-3 positivos sin comprobación post-mortem, por la caída de la proporción de sospechosos con necropsia deberá ser considerada.
La inoculación de extractos de cerebro, médula espinal, ojo, pulmón, hígado, riñón, bazo, ganglio linfático y LCR de pacientes con ECJ puede infectar a primates. Sin embargo, las secreciones, heces y orina no se ha demostrado que transmitan la infección. Por ello, ante un enfermo de ECJ sólo son necesarias medidas preventivas habituales, dado que el riesgo de transmisión a otros miembros de la familia o cuidadores es bajo. No es necesario el aislamiento completo. Sin embargo, deben tomarse precauciones especiales al extraer LCR o al manipular tejidos obtenidos en la autopsia.
Es esencial adoptar medidas de protección para el personal que manipula muestras de tejidos infectados por priones para poder realizar de forma segura los estudios neuropatológicos necesarios. En los laboratorios de anatomía patológica, conviene recordar que al realizar la autopsia de un caso probable de ECJ, deben congelarse muestras del cerebro, generalmente del lóbulo frontal y cerebelo, para poder efectuar un tipaje de proteína de prión y secuenciación del gen de la proteína del prión. Las muestras de los casos de ECJ deben ser manipuladas en campanas de aislamiento (clase 1). Los bloques de tejido que vayan a ser procesados deben ser tratados utilizando agente que inactive el prión, como la inmersión en ácido fórmico puro durante al menos una hora(). Los instrumentos deben ser descontaminados sumergiéndolos en una solución >1N de hidróxido sódico durante al menos 1 hora y luego sometiéndolos a autoclave a 134º C durante al menos 1 hora. Deberán utilizarse instrumentos desechables e incinerar los materiales contaminados siempre que sea posible.
Algunas vacunas están fabricadas con sustancias procedentes de bovinos de países en los que existe la EEB. Sin embargo, el riesgo de transmisión de la vECJ por esta vía se considera remoto y los beneficios de la vacunación sobrepasan a los remotos riesgos de vECJ. Hasta la fecha no existen evidencias de casos de vECJ relacionados con el uso de vacunas. Sin embargo, se recomienda la sustitución paulatina de esas vacunas por otras donde los productos bovinos procedan de países sin riesgo de EEB.
En EE.UU., se estima que un cuarto de las fábricas de piensos no cumplen las regulaciones dispuestas para prevenir la introducción y diseminación de la EEB en ese país, al incluir en esos piensos cerebro y médula espinal.
Se debe pensar en la nueva variante de ECJ ante un paciente joven que desarrolle un cuadro de depresión, al que se asocien alteraciones de la marcha, signos piramidales, extrapiramidales, mutismo acinético o mioclonias, aunque ocurra en un país donde no se haya descrito aún la enfermedad.
Información en Internet en español
· Torres JM, Brun A, Castilla J, Sánchez-Vizcaíno JM. Enfermedades Producidas Por Priones. Organización Colegial Veterinaria Española. http://recol.es/comunidades/veterinaria/eeb/priones/priones.htm
· I Congreso Virtual Iberoamericano de Neurología: http://neurologia.rediris.es/congreso-1/conferencias/priones-10.html
· Consejo General de Colegios Veterinarios de España. http://www.colvet.es/
· Información EEB. Administración General del Estado. http://www.eeb.es/
· Torres JM, Brun A, Castilla J, Sánchez-Vizcaíno JM. Enfermedades Producidas Por Priones. Organización Colegial Veterinaria Española. http://recol.es/comunidades/veterinaria/eeb/priones/priones.htm
- · Centro Nacional de Epidemiología. Instituto de Salud Carlos III.
· I Congreso Virtual Iberoamericano de Neurología: http://neurologia.rediris.es/congreso-1/conferencias/priones-10.html
· Consejo General de Colegios Veterinarios de España. http://www.colvet.es/
· Información EEB. Administración General del Estado. http://www.eeb.es/
Bibliografía consultada
Whitley RJ, MacDonald N, Asher DM, and the Committee on Infectious Diseases. Technical Report: Transmissible Spongiform Encephalopathies: A Review for Pediatricians (T109906). Pediatrics 2000; 106:1160-1165. Disponible en: http://www.aap.org/policy/t109906.html
Detwiler LA, Rubenstein R. Bovine spongiform encephalopathy: an overview. ASAIO J 2000; 46: S73-9.
Haltia, M. Human prion diseases. Ann Med 2000; 32: 493-500.
Mastrianni JA, Roos RP. The Prion Diseases. Sem Neurology 2000; 20:337-352. Disponible en: http://www.medscape.com/thieme/SN/2000/v20.n03/sin2003.01.mast/sin2003.01.mast-01.html
Polo JM. Historia y clasificación de enfermedades por priones en humanos. Rev Neurol 2000; 31: 137-41.
Alom J. Clínica de las enfermedades priónicas humanas. Conferencia en el Primer Congreso Virtual Iberoamericano de Neurología. http://www.uninet.edu/neurocon/congreso-1/conferencias/priones-5.html
Wilesmith JW, Hoinville LJ, Ryan JBM, Sayers AR. Bovine spongiform encephalopathy: aspects of the clinical picture and analyses of possible changes. Vet Rec 1992;130:197-201.
Bateman D, Hilton D, Love S, Zeidelr M, Beck J, Collinge J. Sporadic CJD in a 18-year-old in the UK. Lancet 1995; 346: 1155
Britton TC, Sarraj SA, Shaw C, Campbell T, Collinge J. Sporadic CJD in a 16-year-old in the UK. Lancet 1995; 346: 1155
Will RG, Ironside JW, Zeidler M, Cousens SN, Estibeiro K, Alperovitch A, Poser S, Pocchiari M, Hofman A, Smith PG. A new variant of CJD in the UK. Lancet 1996; 347: 921-925
Whitley RJ, MacDonald N, Asher DM. Technical transmissible spongiform encephalopathies: A review for pediatricians. Pediatrics 2000; 106: 1160-5.
Will RG. The transmision of prions to humans. Acta Paediatr Suppl 1999; 88: 28-21.
Prusiner SB. Novel proteinacious infectious particles cause scrapie. Science 1982; 216: 136-144.
Alper T, Cramp WA, Haig DA, Clarke MC. Does the agent of scrapie replicate without nucleic acid? Nature 1967;214: 764-766
Oesch B, Westaway D, Wälchli M, et al. A cellular gene encodes scrapie PrP 27-30 protein. Cell 1985;40:735-746
Lopez Garcia R, Zahn R, Riek R, Wuthrich K. NMR structure of the bovine prion protein. Proc Natl Acad Sci USA 2000; 97: 8334-9.
Glatzel M, Aguzzi A. Peripheral pathogenesis of prion diseases. Microbes Infect 2000; 2: 613-9.
Büeler H, Aguzzi A, Sailer A, et al. Mice devoid of PrP are resistant to scrapie. Cell 1993;73:1339-1347
Telling GC, Scott M, Mastrianni J, et al. Prion propagation in mice expressing human and chimeric PrP transgenes implicates the interaction of cellular PrP with another protein. Cell 1995;83:79-90
Liao Y-C, Lebo RV, Clawson GA, Smuckler EA. Human prion protein cDNA: molecular cloning, chromosomal mapping, and biological implication. Science 1986;233:364-367.
Moore RC, Lee IY, Silverman GL, et al. Ataxia in prion protein (PrP)-deficient mice is associated with upregulation of the novel PrP-like protein doppel. J Mol Biol 1999;292: 797-817.
Collinge J, Sidle KCL, Meads J, Ironside J, Hill AF. Molecular analysis of prion strain variation and the etiology of new variant CJD. Nature 1996: 383: 685-690.
Hill AF, Zeidler M, Ironside J, Collinge J. Diagnosis of new variant Creutzfeldt-Jakob diseases by tonsil biopsy. Lancet 1997;349:99-100.
Gonzalo I. Cuadrado N. Técnicas de Inmunohistoquímica en las Enfermedades por Priones. Conferencia en el Primer Congreso Virtual Iberoamericano de Neurología. http://www.uninet.edu/neurocon/congreso-1/conferencias/priones-10.html
Gasset M, Westaway D. Los Priones y su Biología. Conferencia en el Primer Congreso Virtual Iberoamericano de Neurología. http://www.uninet.edu/neurocon/congreso-1/conferencias/priones-1.html
Pattison J. The Emergence of Bovine Spongiform Encephalopathy and Related Diseases. Emerging Infectious Diseases 1998; 4:390-394. Disponible en: http://www.medscape.com/govmt/CDC/EID/1998/v04.n03/e0403.06.patt/e0403.06.patt.01.html
Wells GAH, Scott AC, Johnson CT, et al. A novel progressive spongiform encephalopathy in cattle. Vet Rec 1987;121: 419-420
Comisión Europea. Nombre de cas d'Encéphalopathie Spongiforme Bovine. http://europa.eu.int/comm/food/fs/bse/bse26_fr.pdf
Centro Nacional de Epidemiología. Instituto de Salud Carlos III.
http://www.isciii.es/unidad/Sgecnsp/centros/cne/ccneindex.html
The UK CJD Surveillance Unit (1998). http://www.cjd.ed.ac.uk/
Will RG, Cousens SN, Farrington CP, Smith PG, Knight RSG, Ironside JW. Deaths from variant Creutzfeldt-Jakob disease. The Lancet 1999; 353: 979.
Heras Pérez, J.A. Nueva variante de la Enfermedad de Creutzfeldt-Jakob: primer caso diagnosticado en España. Conferencia en el Primer Congreso Virtual Iberoamericano de Neurología. http://www.uninet.edu/neurocon/congreso-1/conferencias/priones-6.html
Cuillé J, Chelle PL. Experimental transmission of trembling to the goat. C R Seances Acad Sci 1939;208:1058-1060
Gajdusek DC, Gibbs CJ Jr, Alpers M. Experimental transmission of a kuru-like syndrome to chimpanzees. Nature 1966;209: 794-796.
Gibbs CJ Jr, Gajdusek DC, Asher DM, et al. Creutzfeldt-Jakob disease (spongiform encephalopathy): transmission to the chimpanzee. Science 1968;161:388-389.
Knox B. Consumer perception and understanding of risk from food. Br Med Bull 2000; 56: 97-109.
Litjen Tan L, Williams MA, Khan MK, Champion HC, Nielsen NH. Risk of Transmission of Bovine Spongiform Encephalopathy to Humans in the United States. Report of the Council on Scientific Affairs. JAMA. 1999;281:2330-2339. Disponible en: http://jama.ama-assn.org/issues/v281n24/abs/jcn90000.html
Escudero Torrella J. Cronología de la Nueva Variante de la Enfermedad de Creutzfeldt-Jakob. Conferencia en el Primer Congreso Virtual Iberoamericano de Neurología. http://www.uninet.edu/neurocon/congreso-1/conferencias/priones-4.html
Brown P, Cervenakova L, McShane LM, Barber P, Rubenstein R, Drohan WN. Further studies of blood infectivity in an experimental model of transmissible spongiform encephalopathy, with an explanation of why blood components do not transmit Creutzfeldt-Jakob disease in humans. Transfusion 1999; 39: 1169-78.
Rossi F, Legras JF. Viral safety: European and French directives. Ann Med Interne (Paris) 2000: 151 Suppl 1: 1S55-61.
Foster PR. Prions and blood products. Ann Med 2000; 32: 501-13.
Dobson R. Scientists show that vCJD can be transmitted through blood transfusion. BMJ 2000;321:726. Disponible en: http://www.bmj.com/cgi/content/full/321/7263/726/e
Antloga K, Meszaros J, Malchesky PS, McDonnell GE. Prion disease and medical devices. ASAIO J 2000; 46: S69-72.
Reuters Medical News. Fears of 'Mad Cow Disease' Prompt US to Consider Tighter Blood Donation Limits. Medcape News: http://www.medscape.com/reuters/prof/2001/01/01.18/20010117publ003.html
European Commission . Community legislation on BSE. 8 de enero de 2001. http://europa.eu.int/comm/food/fs/bse/bse15_en.pdf
de Pedro J. Futuro y problemática de la Vigilancia Epidemiológica de la Enfermedad de Creutzfeldt-Jakob. Conferencia en el Primer Congreso Virtual Iberoamericano de Neurología. http://www.uninet.edu/neurocon/congreso-1/conferencias/priones-15.html
Timperley WR. Neuropathology J Clin Pathol 2000; 53:255-265. Disponible en: http://jcp.bmjjournals.com/cgi/content/full/53/4/255
Centers for Disease Control. Public Health Service Recommendations for the Use of Vaccines Manufactured with Bovine-Derived Materials. Morbidity & Mortality Weekly Report. MMWR 49(50):1137-1138, 2000. Disponible en: http://www.medscape.com/govmt/CDC/MMWR/2000/12.00/mmwr4950.04/mmwr4950.04.html
Reuters Medical News. 11 enero 2001. One Quarter of Feed Makers Noncompliant With 'Mad Cow Disease' Rules. Medcape News: http://www.medscape.com/reuters/prof/2001/01/01.12/20010111rglt002.html
Whitley RJ, MacDonald N, Asher DM, and the Committee on Infectious Diseases. Technical Report: Transmissible Spongiform Encephalopathies: A Review for Pediatricians (T109906). Pediatrics 2000; 106:1160-1165. Disponible en: http://www.aap.org/policy/t109906.html
Detwiler LA, Rubenstein R. Bovine spongiform encephalopathy: an overview. ASAIO J 2000; 46: S73-9.
Haltia, M. Human prion diseases. Ann Med 2000; 32: 493-500.
Mastrianni JA, Roos RP. The Prion Diseases. Sem Neurology 2000; 20:337-352. Disponible en: http://www.medscape.com/thieme/SN/2000/v20.n03/sin2003.01.mast/sin2003.01.mast-01.html
Polo JM. Historia y clasificación de enfermedades por priones en humanos. Rev Neurol 2000; 31: 137-41.
Alom J. Clínica de las enfermedades priónicas humanas. Conferencia en el Primer Congreso Virtual Iberoamericano de Neurología. http://www.uninet.edu/neurocon/congreso-1/conferencias/priones-5.html
Wilesmith JW, Hoinville LJ, Ryan JBM, Sayers AR. Bovine spongiform encephalopathy: aspects of the clinical picture and analyses of possible changes. Vet Rec 1992;130:197-201.
Bateman D, Hilton D, Love S, Zeidelr M, Beck J, Collinge J. Sporadic CJD in a 18-year-old in the UK. Lancet 1995; 346: 1155
Britton TC, Sarraj SA, Shaw C, Campbell T, Collinge J. Sporadic CJD in a 16-year-old in the UK. Lancet 1995; 346: 1155
Will RG, Ironside JW, Zeidler M, Cousens SN, Estibeiro K, Alperovitch A, Poser S, Pocchiari M, Hofman A, Smith PG. A new variant of CJD in the UK. Lancet 1996; 347: 921-925
Whitley RJ, MacDonald N, Asher DM. Technical transmissible spongiform encephalopathies: A review for pediatricians. Pediatrics 2000; 106: 1160-5.
Will RG. The transmision of prions to humans. Acta Paediatr Suppl 1999; 88: 28-21.
Prusiner SB. Novel proteinacious infectious particles cause scrapie. Science 1982; 216: 136-144.
Alper T, Cramp WA, Haig DA, Clarke MC. Does the agent of scrapie replicate without nucleic acid? Nature 1967;214: 764-766
Oesch B, Westaway D, Wälchli M, et al. A cellular gene encodes scrapie PrP 27-30 protein. Cell 1985;40:735-746
Lopez Garcia R, Zahn R, Riek R, Wuthrich K. NMR structure of the bovine prion protein. Proc Natl Acad Sci USA 2000; 97: 8334-9.
Glatzel M, Aguzzi A. Peripheral pathogenesis of prion diseases. Microbes Infect 2000; 2: 613-9.
Büeler H, Aguzzi A, Sailer A, et al. Mice devoid of PrP are resistant to scrapie. Cell 1993;73:1339-1347
Telling GC, Scott M, Mastrianni J, et al. Prion propagation in mice expressing human and chimeric PrP transgenes implicates the interaction of cellular PrP with another protein. Cell 1995;83:79-90
Liao Y-C, Lebo RV, Clawson GA, Smuckler EA. Human prion protein cDNA: molecular cloning, chromosomal mapping, and biological implication. Science 1986;233:364-367.
Moore RC, Lee IY, Silverman GL, et al. Ataxia in prion protein (PrP)-deficient mice is associated with upregulation of the novel PrP-like protein doppel. J Mol Biol 1999;292: 797-817.
Collinge J, Sidle KCL, Meads J, Ironside J, Hill AF. Molecular analysis of prion strain variation and the etiology of new variant CJD. Nature 1996: 383: 685-690.
Hill AF, Zeidler M, Ironside J, Collinge J. Diagnosis of new variant Creutzfeldt-Jakob diseases by tonsil biopsy. Lancet 1997;349:99-100.
Gonzalo I. Cuadrado N. Técnicas de Inmunohistoquímica en las Enfermedades por Priones. Conferencia en el Primer Congreso Virtual Iberoamericano de Neurología. http://www.uninet.edu/neurocon/congreso-1/conferencias/priones-10.html
Gasset M, Westaway D. Los Priones y su Biología. Conferencia en el Primer Congreso Virtual Iberoamericano de Neurología. http://www.uninet.edu/neurocon/congreso-1/conferencias/priones-1.html
Pattison J. The Emergence of Bovine Spongiform Encephalopathy and Related Diseases. Emerging Infectious Diseases 1998; 4:390-394. Disponible en: http://www.medscape.com/govmt/CDC/EID/1998/v04.n03/e0403.06.patt/e0403.06.patt.01.html
Wells GAH, Scott AC, Johnson CT, et al. A novel progressive spongiform encephalopathy in cattle. Vet Rec 1987;121: 419-420
Comisión Europea. Nombre de cas d'Encéphalopathie Spongiforme Bovine. http://europa.eu.int/comm/food/fs/bse/bse26_fr.pdf
Centro Nacional de Epidemiología. Instituto de Salud Carlos III.
http://www.isciii.es/unidad/Sgecnsp/centros/cne/ccneindex.html
The UK CJD Surveillance Unit (1998). http://www.cjd.ed.ac.uk/
Will RG, Cousens SN, Farrington CP, Smith PG, Knight RSG, Ironside JW. Deaths from variant Creutzfeldt-Jakob disease. The Lancet 1999; 353: 979.
Heras Pérez, J.A. Nueva variante de la Enfermedad de Creutzfeldt-Jakob: primer caso diagnosticado en España. Conferencia en el Primer Congreso Virtual Iberoamericano de Neurología. http://www.uninet.edu/neurocon/congreso-1/conferencias/priones-6.html
Cuillé J, Chelle PL. Experimental transmission of trembling to the goat. C R Seances Acad Sci 1939;208:1058-1060
Gajdusek DC, Gibbs CJ Jr, Alpers M. Experimental transmission of a kuru-like syndrome to chimpanzees. Nature 1966;209: 794-796.
Gibbs CJ Jr, Gajdusek DC, Asher DM, et al. Creutzfeldt-Jakob disease (spongiform encephalopathy): transmission to the chimpanzee. Science 1968;161:388-389.
Knox B. Consumer perception and understanding of risk from food. Br Med Bull 2000; 56: 97-109.
Litjen Tan L, Williams MA, Khan MK, Champion HC, Nielsen NH. Risk of Transmission of Bovine Spongiform Encephalopathy to Humans in the United States. Report of the Council on Scientific Affairs. JAMA. 1999;281:2330-2339. Disponible en: http://jama.ama-assn.org/issues/v281n24/abs/jcn90000.html
Escudero Torrella J. Cronología de la Nueva Variante de la Enfermedad de Creutzfeldt-Jakob. Conferencia en el Primer Congreso Virtual Iberoamericano de Neurología. http://www.uninet.edu/neurocon/congreso-1/conferencias/priones-4.html
Brown P, Cervenakova L, McShane LM, Barber P, Rubenstein R, Drohan WN. Further studies of blood infectivity in an experimental model of transmissible spongiform encephalopathy, with an explanation of why blood components do not transmit Creutzfeldt-Jakob disease in humans. Transfusion 1999; 39: 1169-78.
Rossi F, Legras JF. Viral safety: European and French directives. Ann Med Interne (Paris) 2000: 151 Suppl 1: 1S55-61.
Foster PR. Prions and blood products. Ann Med 2000; 32: 501-13.
Dobson R. Scientists show that vCJD can be transmitted through blood transfusion. BMJ 2000;321:726. Disponible en: http://www.bmj.com/cgi/content/full/321/7263/726/e
Antloga K, Meszaros J, Malchesky PS, McDonnell GE. Prion disease and medical devices. ASAIO J 2000; 46: S69-72.
Reuters Medical News. Fears of 'Mad Cow Disease' Prompt US to Consider Tighter Blood Donation Limits. Medcape News: http://www.medscape.com/reuters/prof/2001/01/01.18/20010117publ003.html
European Commission . Community legislation on BSE. 8 de enero de 2001. http://europa.eu.int/comm/food/fs/bse/bse15_en.pdf
de Pedro J. Futuro y problemática de la Vigilancia Epidemiológica de la Enfermedad de Creutzfeldt-Jakob. Conferencia en el Primer Congreso Virtual Iberoamericano de Neurología. http://www.uninet.edu/neurocon/congreso-1/conferencias/priones-15.html
Timperley WR. Neuropathology J Clin Pathol 2000; 53:255-265. Disponible en: http://jcp.bmjjournals.com/cgi/content/full/53/4/255
Centers for Disease Control. Public Health Service Recommendations for the Use of Vaccines Manufactured with Bovine-Derived Materials. Morbidity & Mortality Weekly Report. MMWR 49(50):1137-1138, 2000. Disponible en: http://www.medscape.com/govmt/CDC/MMWR/2000/12.00/mmwr4950.04/mmwr4950.04.html
Reuters Medical News. 11 enero 2001. One Quarter of Feed Makers Noncompliant With 'Mad Cow Disease' Rules. Medcape News: http://www.medscape.com/reuters/prof/2001/01/01.12/20010111rglt002.html

